- HOME
- 本プログラムについて
- ターゲットタンパク研究「基本的な生命の解明」分野
- H+-ATPaseF0
H+-ATP合成酵素膜内在F0の機能構造と不正規構造の固体NMRによる解明(H19〜H21)
ATP生産関連膜蛋白質系の構造と機能解析(H22改題)
代表機関:大阪大学蛋白質研究所
代表研究者:阿久津秀雄
2010年版パンフレット(背景と成果)の該当ページはこちら
ヒトの体は細胞からなっていますが、その細胞には核をはじめ、ミトコンドリア、ゴルジ体などさまざまな細胞小器官があります。このような細胞を真核細胞といい、真核細胞からなる生物を真核生物といいます。一方、細菌は1個の細胞からなり、その細胞には核も他の細胞小器官もありません。このような細胞を原核細胞といい、原核細胞からなる生物を原核生物といいます。
このように細胞のつくりはずいぶん違いますが、細胞の活動には共通するところもたくさんあります。例えば、真核生物も、多くの原核生物も、細胞の中でエネルギーを流通させるのにATPという物質を利用しています。外界から多様な方法で取り込んだエネルギーを、最終的にATPというエネルギーの高い物質に変え、まるで通貨のように細胞内の各所で利用しているのです。
私たちは、細菌がATPをつくるときにはたらく、H+-ATP合成酵素(F1-F0 ATP合成酵素)を研究しています。(右ページの課題には真核細胞がATPをつくるときにはたらくF1-F0ATP合成酵素が出てきますが、両者の基本構造とはたらきはよく似ています。)
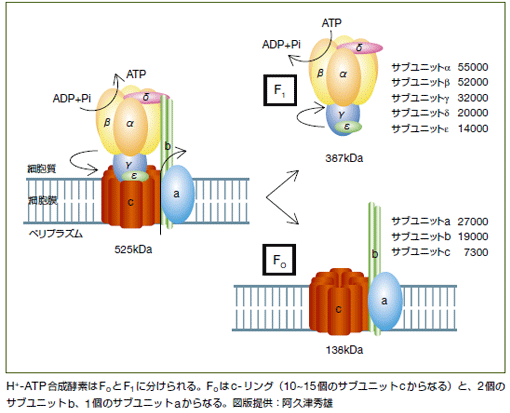
H+-ATP合成酵素は多くのタンパク質部品(サブユニット)からなる複雑な複合体ですが、大きくF0とF1に分けられます。F0は細菌の細胞膜に埋め込まれており、F1は細胞膜のすぐ内側にあって6枚羽根のプロペラのようなかたちをしています。細胞膜の外側にあるプロトンがF0を通って細胞の中に流れ込むと、F1の軸が回転し、それにより羽根の一部がピストン運動をしてATPをつくります。F0は、プロトンの流れをF1の回転に変える重要なはたらきをしているのです。
しかし、F0は膜に埋め込まれているため、まだ構造解析は成功しておらず、その機能の詳しいメカニズムはわかっていません。そこで、私たちはまず、F0のうちでもプロトンの流れを自分自身の回転に変えるc-リングという部分に焦点を絞って構造解析に取り組みます。構造解析は固体NMRという方法で行うため、c-リングの構成原子の一部をNMR測定に適した同位体に変え、膜に埋め込まれた状態の試料を用意します。それと並行して、NMR測定法自体も開発していきます。その後、F0全体の構造と機能の解析に進む計画です。
F0の機能はヒトなどの真核生物でも同じであり、この研究には、生物にとってもっとも重要なエネルギー変換のしくみを明らかにするという大きな意義があります。また、ヒトのバッテン病という遺伝子病では、c-リングの構成単位であるサブユニットcが脳神経細胞に蓄積され、細胞に障害を与えることがわかっています。そのメカニズムの解明にも、私たちは取り組む予定です。

 サイト内検索
サイト内検索